Reakcje charakterystyczne jonów żelaza Fe2+ i Fe3+
Żelazo jest lśniącym srebrzystobiałym metalem, miękkim i kowalnym. Posiada właściwości ferromagnetyczne. Chemicznie czyste żelazo jest odporne na działanie wilgoci i tlenu z powietrza. Natomiast żelazo techniczne zawiera domieszki innych pierwiastków (np. węgla, krzemu, siarki, manganu) przez co łatwo ulega korozji (rdzewieje). W przyrodzie żelazo nie występuje w postaci wolnej, ale w postaci minerałów np. magnetytu Fe3O4, hematytu Fe2O3, syderytu FeCO3 czy pirytu FeS2.

Liczba atomowa: 26
Masa atomowa: 55,845 u
Elektroujemność: 1,9
Promień atomowy: 124 pm
Konfiguracja elektronowa: [Ar] 4s2 3d6
Gęstość: 7,87 g/cm3
Temperatura topnienia: 1538°C
Temperatura wrzenia: 2861°C
Najczęstsze stopnie utlenienia: +2, +3
Liczba koordynacji w związkach kompleksowych: 6
W analizie jakościowej jony żelaza Fe2+ i Fe3+ są przypisane do III grupy kationów (podział wg Freseniusa), której odczynnikiem grupowym jest amid kwasu tiooctowego (AKT) in. tioacetamid z dodatkiem NH4Cl i NH3(aq). Odczynniki grupowy wytrąca z roztworu próbki czarny osad siarczku żelaza(II) FeS i czarny osad siarczku żelaza(III) Fe2S3, który następnie poddawany jest dalszej analizie.
Poniżej przedstawiono wybrane reakcje charakterystyczne jonów żelaza Fe2+ i Fe3+.
Wybrane reakcje charakterystyczne jonu Fe2+
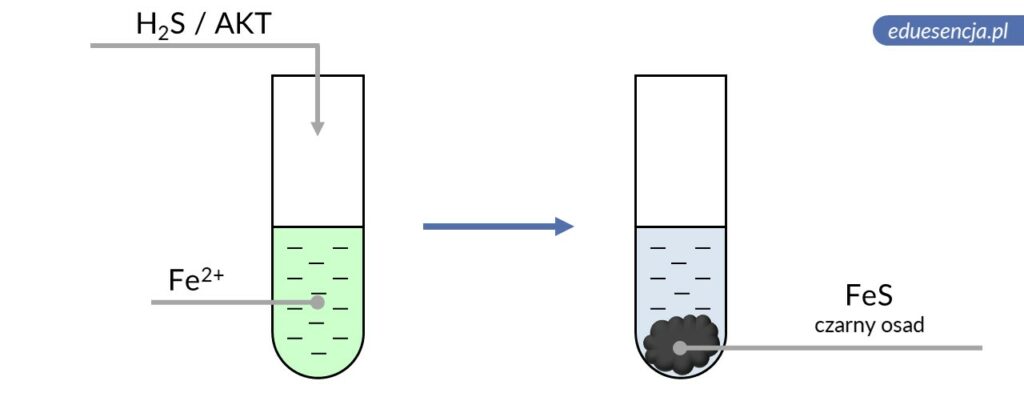
| Odczynnik: | Siarkowodór lub amid kwasu tiooctowego (H2S aq. lub AKT) |
| Reakcja: | Fe2+ + H2S → FeS↓ + 2 H+ |
| Produkt: | Siarczek żelaza(II) – czarny osad |
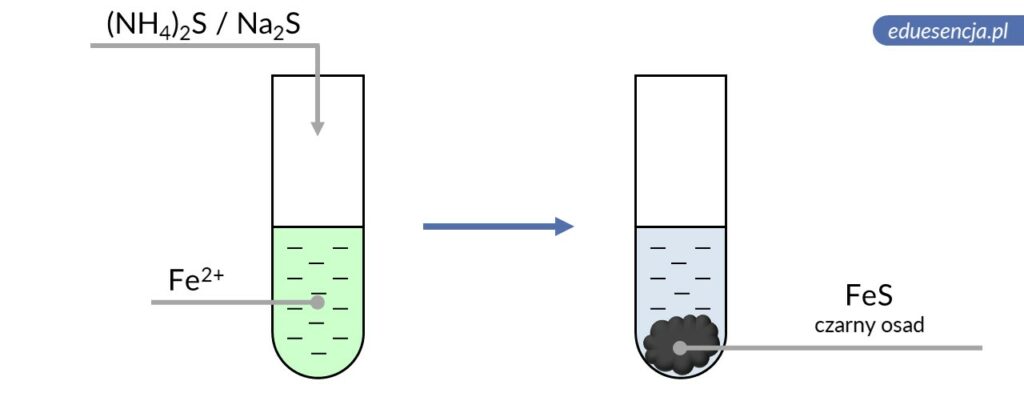
| Odczynnik: | Siarczek amonu lub sodu ((NH4)2S lub Na2S) |
| Reakcja: | Fe2+ + S2- → FeS↓ |
| Produkt: | Siarczek żelaza(II) – czarny osad |
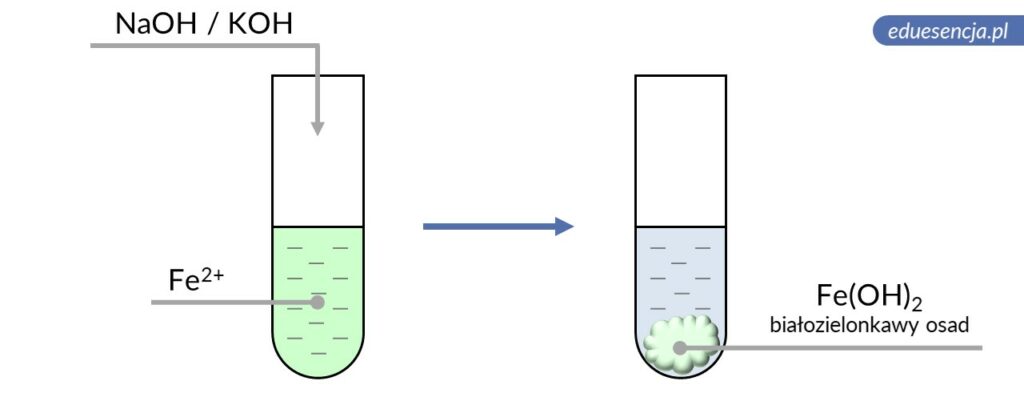
| Odczynnik: | Wodorotlenek sodu lub potasu (NaOH lub KOH) |
| Reakcja: | Fe2+ + 2 OH– → Fe(OH)2↓ |
| Produkt: | Wodorotlenek żelaza(II) – białozielonkawy osad |
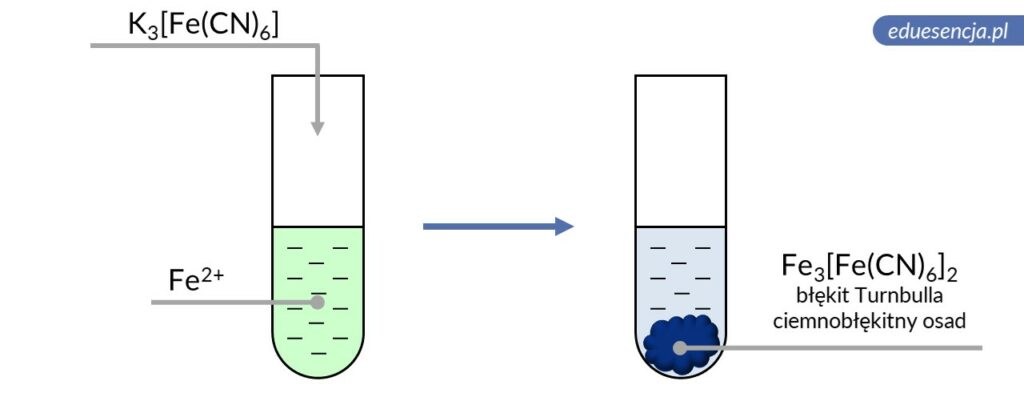
| Odczynnik: | Heksacyjanożelazian(III) potasu (K3[Fe(CN)6]) |
| Reakcja: | 3 Fe2+ + 2 [Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ |
| Produkt: | Heksacyjanożelazian(III) żelaza(II) – ciemnobłękitny osad tzw. błękit Turnbulla |
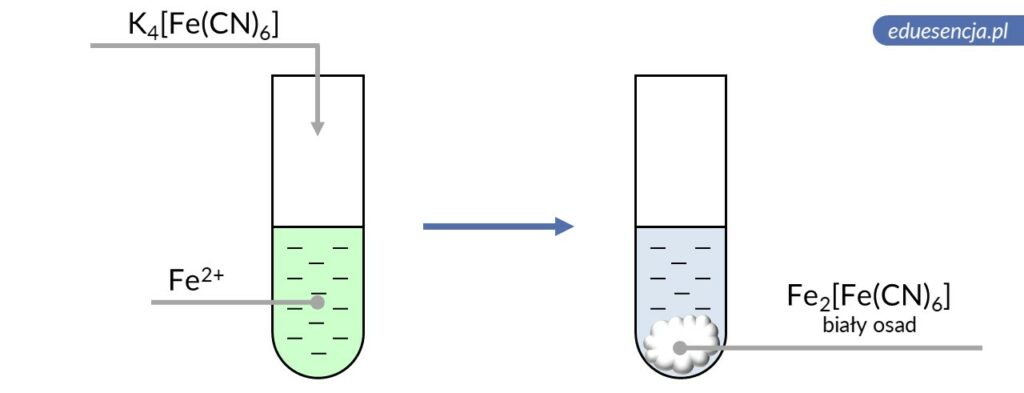
| Odczynnik: | Heksacyjanożelazian(II) potasu (K4[Fe(CN)6]) |
| Reakcja: | 2 Fe2+ + [Fe(CN)6]4- → Fe2[Fe(CN)6]↓
lub Fe2+ + 2 K+ + [Fe(CN)6]4- → K2Fe[Fe(CN)6]↓ |
| Produkt: | Heksacyjanożelazian(II) żelaza(II) – biały osad
lub osad heksacyjanożelazianu(II) dipotasu żelaza(II) |
Wybrane reakcje charakterystyczne jonu Fe3+
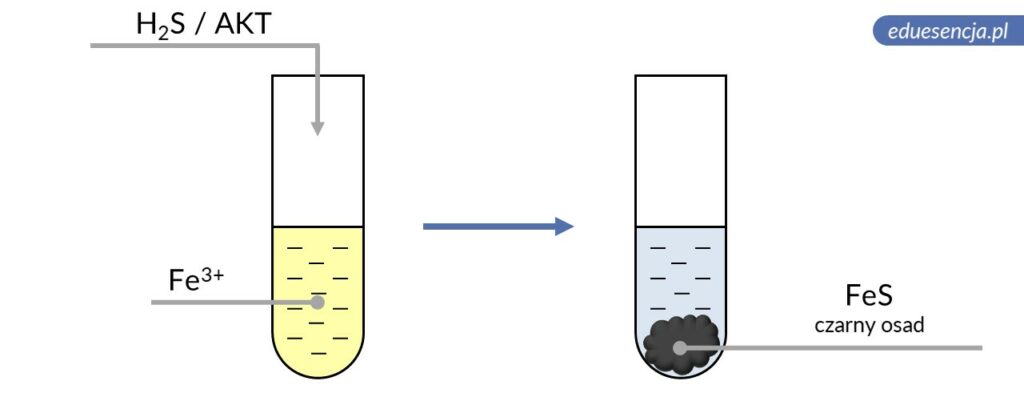
| Odczynnik: | Siarkowodór lub amid kwasu tiooctowego (H2S lub AKT) |
| Reakcja: | 2 Fe3+ + H2S → 2 Fe2+ + S0↓ + 2 H+
Fe2+ + S2- → FeS↓ |
| Produkt: | Siarczek żelaza(II) – czarny osad |
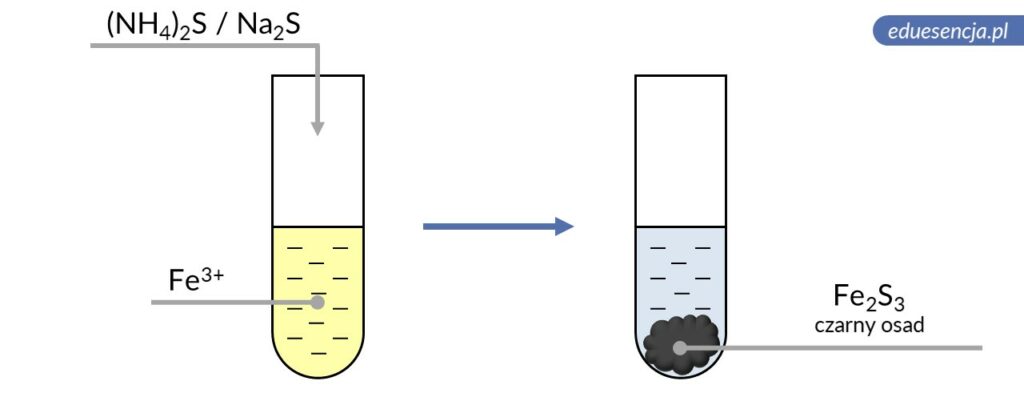
| Odczynnik: | Siarczek amonu lub sodu ((NH4)2S lub Na2S) |
| Reakcja: | 2 Fe3+ + 3 S2- → Fe2S3↓ |
| Produkt: | Siarczek żelaza(III) – czarny osad |
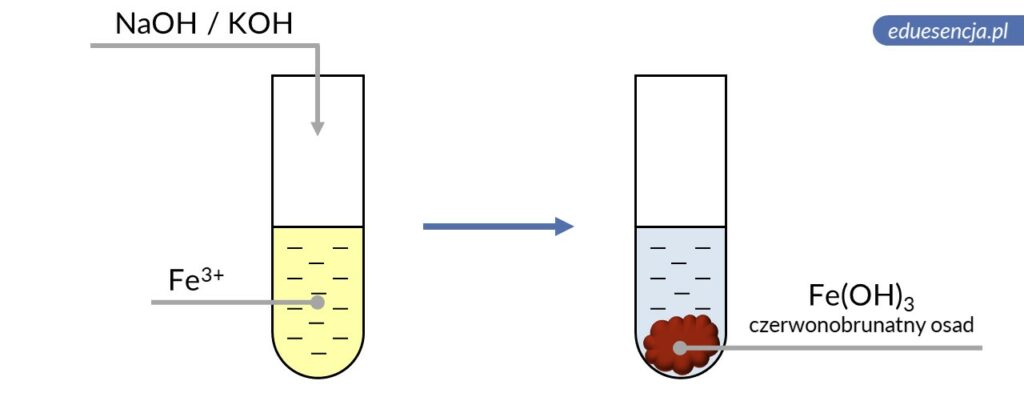
| Odczynnik: | Wodorotlenek sodu lub potasu (NaOH lub KOH) |
| Reakcja: | Fe3+ + 3 OH– → Fe(OH)3↓ |
| Produkt: | Wodorotlenek żelaza(III) – czerwonobrunatny osad |
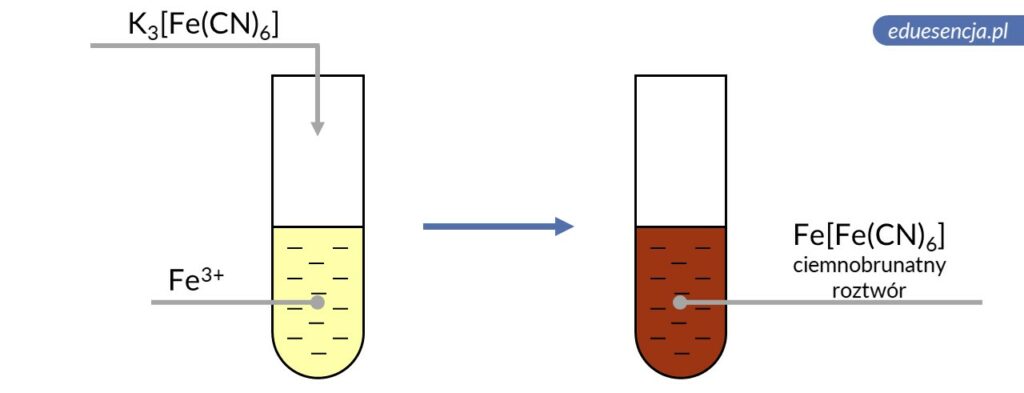
| Odczynnik: | Heksacyjanożelazian(III) potasu (K3[Fe(CN)6]) |
| Reakcja: | Fe3+ + Fe(CN)63- → Fe[Fe(CN)6] |
| Produkt: | Heksacyjanożelazian(III) żelaza(III) – ciemnobrunatny roztwór |
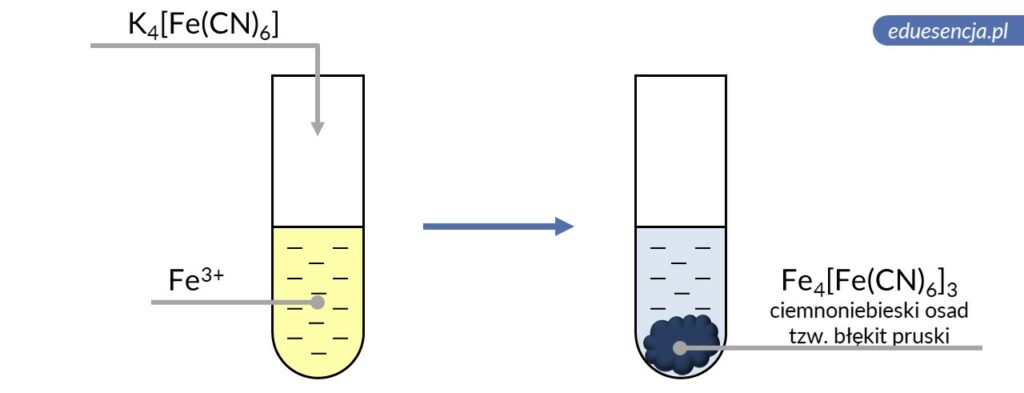
| Odczynnik: | Heksacyjanożelazian(II) potasu (K4[Fe(CN)6]) |
| Reakcja: | 4 Fe3+ + 3 [Fe(CN)6]4- → Fe4[Fe (CN)6]3↓ |
| Produkt: | Heksacyjanożelazian(II) żelaza(III) – ciemnoniebieski osad tzw. błękit pruski |
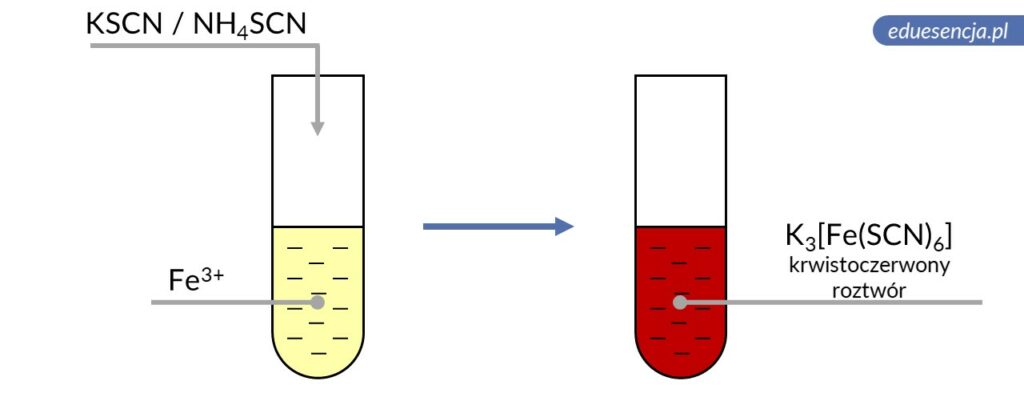
| Odczynnik: | Tiocyjanek potasu lub amonu (rodanek potasu lub amonu) (KSCN lub NH4SCN) |
| Reakcja: | Fe3+ + 6 SCN– → [Fe(SCN)6]3- |
| Produkt: | Heksatiocyjanianożelazian(III) potasu lub amonu – krwistoczerwony roztwór |
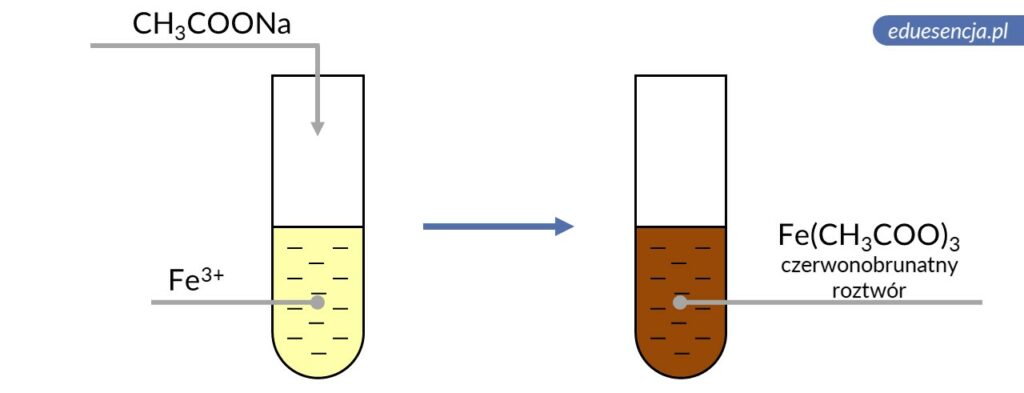
| Odczynnik: | Octan sodu (CH3COONa) |
| Reakcja: | Fe3+ + 3 CH3COO– → Fe(CH3COO)3 |
| Produkt: | Octan żelaza(III) – czerwonobrunatny roztwór |
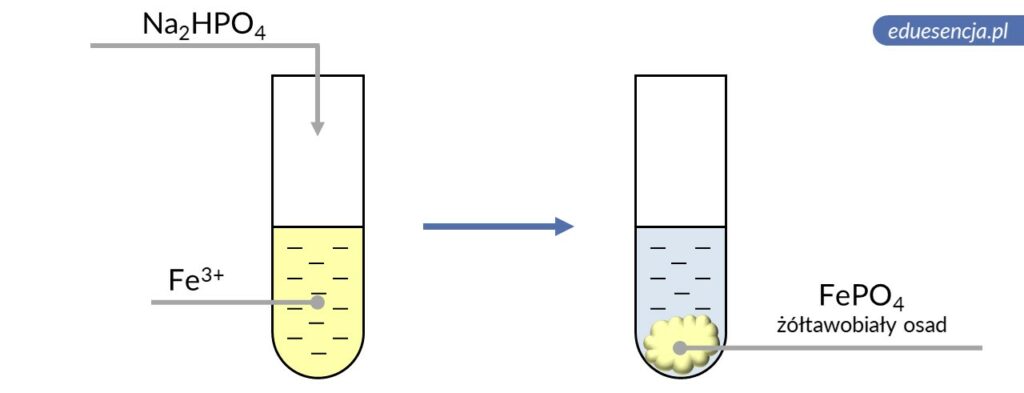
| Odczynnik: | Wodoroortofosforan(V) disodu (Na2HPO4) |
| Reakcja: | Fe3+ + HPO42- → FePO4↓ + H+ |
| Produkt: | Ortofosforan(V) żelaza(III) – żółtawobiały osad |